
Wasser ist in der Zellbiologie essenziell – es besitzt einzigartige Eigenschaften, die Leben ermöglichen. Drei Schlüsseleigenschaften des Wassers sind besonders relevant und werden in der wissenschaftlichen Literatur beschrieben:
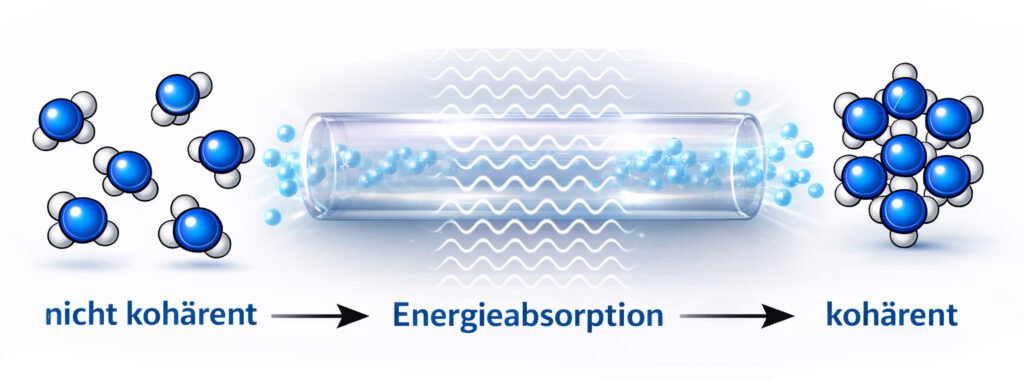
Wenn Wassermoleküle bestimmte elektromagnetische Energien absorbieren, bilden sich kohärente Domänen, das sind winzige Bereiche in
erhöhter Ordnung (niedrigem Entropieniveau). Diese übertragen sich, ähnlich wie eine La-Ola-Welle im Stadion, schnell auf die umgebenden
Wassermoleküle. Wenn diese Domänen an eine Oberfläche stossen, bildet sie eine dünne Schicht geordneter Wassermoleküle aus, die
sogenannte Exclusion-Zone (EZ). Ohne einen ständigen Nachschub an kohärenten Domänen sind diese EZs kurzlebig und können auch nicht
gespeichert werden. Sie spielen aber eine entscheidende Rolle in biologischen Prozessen
Nach der Quantenelektrodynamik (QED) Theorie des Wassers (entwickelt von Del Giudice, Preparata und Vitiello), entstehen kohärente Domänen (CDs) im flüssigen Wasser unter dem Einfluss von elektromagnetischen Feldern (EMF).
Die Erzeugung dieser Domänen erfolgt nicht durch eine einfache chemische Reaktion, sondern durch physikalische Prozesse, die die molekulare Anordnung und Schwingung beeinflussen. Kohärente Domänen repräsentieren einen Zustand erhöhter lokaler Ordnung im Wasser, der durch die Wechselwirkung mit Grenzflächen und elektromagnetischen Feldern induziert wird. Dieses Phänomen ist zentral für die Erklärung der einzigartigen physikalischen Eigenschaften von Wasser in biologischen Systemen.
In der Zellbiologie sind die Eigenschaften des Wassers – Energieabsorption, Bildung kohärenter Domänen und Oberflächenordnung –
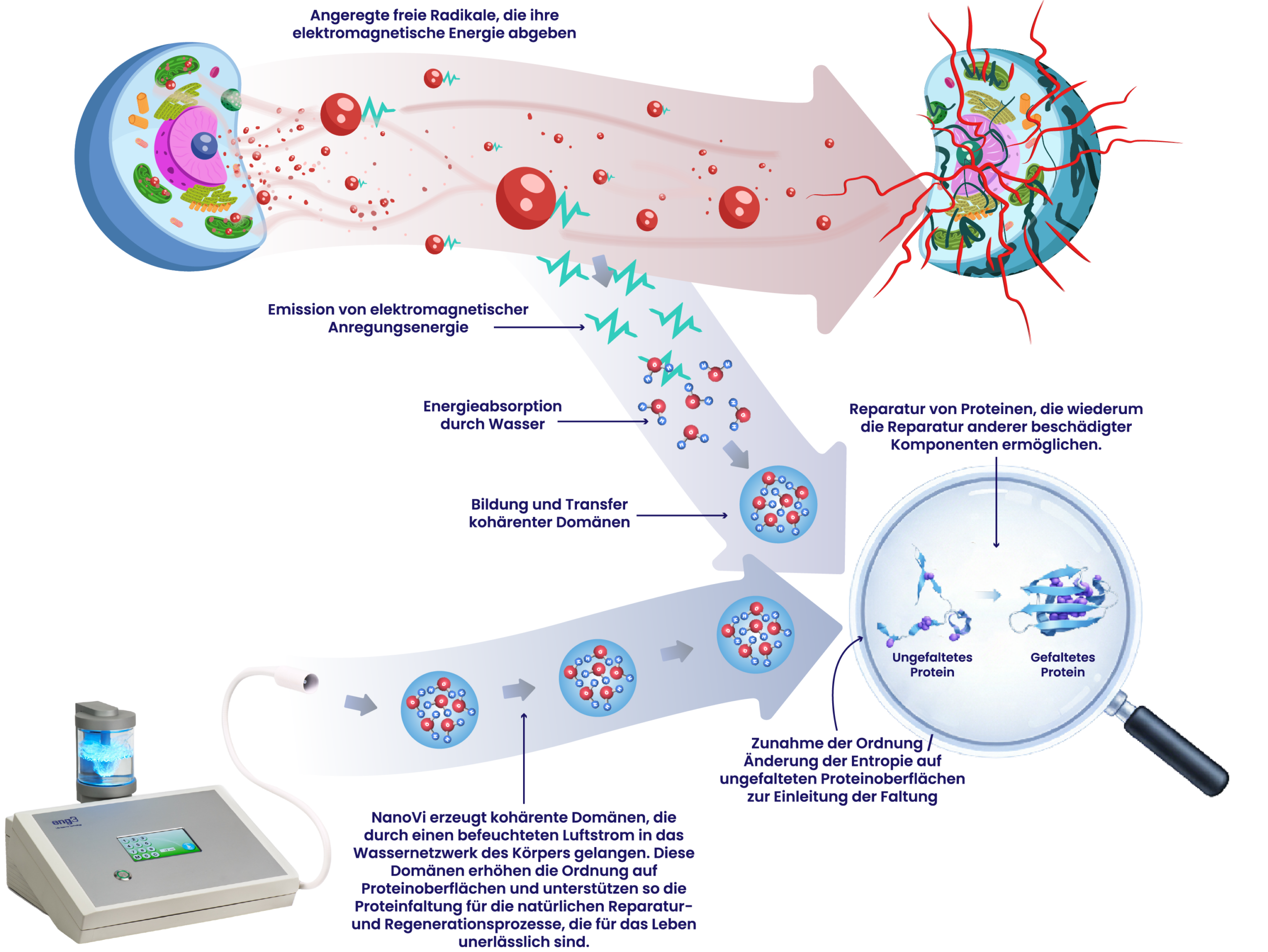
grundlegend für die Proteinfaltung. Der Prozess beginnt mit der Freisetzung spezifischer, absorbierbarer elektromagnetischer Energie durch
angeregte freie Radikale. Diese Energie wird von den umgebenden Wassermolekülen absorbiert und bildet kohärente Domänen, die auf der
Oberfläche ungefalteter Proteine eine dünne Schicht höher geordneter Wassermoleküle bilden. Anschließend findet der für die Proteinfaltung
entscheidende Entropieaustausch statt. Ungefaltete Proteine liegen in einem ungeordneten Zustand (hohe Entropie) vor. Um sich zu
einem höher geordneten Protein zu falten, muss das ungefaltete Protein in einen geordneten Zustand (niedrige Entropie) übergehen. Das
Wasser gibt seine Ordnung ab, die Proteine gewinnen an Ordnung, falten sich und werden strukturiert und funktionsfähig.
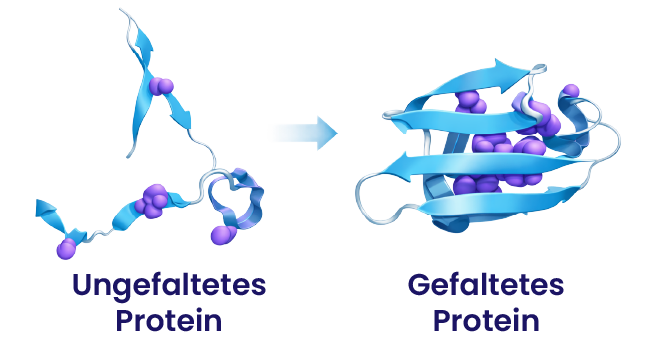
Die Protein-Faltung ist ein thermodynamischer Prozess, der durch eine Änderung der Entropie zwischen dem Protein und der dünnen Schicht geordneten Wassers, die es umgibt, gesteuert wird. Funktionierende Proteine entstehen, wenn eine ungefaltete Aminosäurekette von einem Zustand niedriger Ordnung (hoher Entropie) in einen Zustand hoher Ordnung (niedriger Entropie) übergeht.
Geordnetes Wasser, auch Exklusionszonen-Wasser (EZ-Wasser) genannt, besitzt eine geringe Entropie, da seine Moleküle hochstrukturiert sind. Im Gegensatz dazu hat eine ungefaltete Aminosäurekette eine hohe Entropie, da sie ungeordnet ist.
Wenn eine ungefaltete Aminosäurekette von geordnetem Wasser mit niedriger Entropie umgeben wird, kann es zu einer Änderung der Entropie kommen. Dieser Übergang führt dazu, dass die Ordnung in den Wasserschichten um das Protein abnimmt, wodurch sich das Protein in seine hochgeordnete, funktionelle 3D-Struktur faltet. Dieser Mechanismus zeigt, wie entscheidend die richtige Wasserstruktur für eine effiziente Protein-Faltung und damit für die Zellfunktion ist.
Die Proteinfaltung ist ein komplexer thermodynamischer Prozess, der einen Entropiewechsel (Änderung der Entropie) benötigt und diesen auch beinhaltet. Der Prozess ist ein faszinierendes Beispiel für das Zusammenspiel von Entropie und Enthalpie im biologischen System.
Der Netto-Entropiewechsel während der Proteinfaltung ist negativ, das System wird also geordneter. Dies scheint dem Zweiten Hauptsatz der Thermodynamik zu widersprechen, der besagt, dass die Entropie in einem isolierten System zunehmen muss. Die Proteinfaltung ist jedoch kein isoliertes System; sie findet in wässriger Lösung statt.
Der Gesamtprozess wird durch das Gibbs-Helmholtz-Kriterium beschrieben:
ΔG = ΔH – TΔS
Damit Faltung spontan abläuft, muss die freie Gibbs-Energie (ΔG) negativ sein.
Der Entropiebeitrag (ΔS) lässt sich in zwei Hauptkomponenten unterteilen:
Der Gesamt-Entropiewechsel (ΔSGesamt) für das System (Protein + Wasser) setzt sich zusammen aus dem negativen Beitrag des Proteins und dem positiven Beitrag des Wassers.
ΔSGesamt = ΔSProtein + ΔSWasser
Der positive Entropiegewinn durch das Lösungswasser ist in der Regel groß genug, um den negativen Entropieverlust des Proteins auszugleichen oder sogar zu übertreffen.
Der hydrophobe Effekt ist somit die Hauptantriebskraft für die Proteinfaltung, angetrieben durch den Entropiegewinn des Wassers.